4) CHIMIE PRATIQUE DU SO2
4.1 Propriétés générales du SO2
Très réactif, le SO2 se trouve en solutions organiques sous de nombreuses formes évolutives d'intérêt œnologique très varié, aujourd'hui bien connues.
En présence d'oxygène , le soufre S brûle en dégageant une « odeur de soufre » caractéristique due à la formation de dioxyde de soufre SO2.
S + O2 ==> SO2
Ce gaz est disponible sous forme gazeuse et/ou liquide selon les conditions de pression et de température et ses constantes physico-chimiques .
Température fusion = -72,7 °C ; Température ébullition = -10 °C
Température critique = 157,8 °C ; Pression critique = 77,7 atm.
Il est très soluble dans l'eau froide mais il s'évapore facilement lorsque la température s'élève.
Solubilité |
Température |
| g SO2 / litre eau |
°C |
| 228.3 |
0 |
| 162.1 |
10 |
112.9 |
20 |
78.1 |
30 |
54.1 |
40 |
Ayant une chaleur de vaporisation élevée (environ 92 kcal/kg à 20°C), il a été utilisé comme fluide réfrigérant. Le dioxyde de soufre est oxydable en trioxyde de soufre SO3 (=anhydride sulfurique) mais la réaction est lente en l'absence d'eau ou de catalyseur.
4.2. SO2 en solutions aqueuses
En solution aqueuse le SO2 forme l'acide sulfureux H2 SO3
SO 2 + H 2 O ==> H 2 SO 3 (1)
ionisé en hydrogénosulfite H SO3- (= bisulfite) et en sulfite SO3 -- - selon les équations suivantes :
H 2 SO 3  H SO 3 - + H + (2)
H SO 3 - + H + (2)
H SO3-  S O 3 -- + H + (3)
S O 3 -- + H + (3)
Ces équilibres sont régis par les équations suivantes :

K1, K2 = constantes de dissociation de l'acide sulfureux
Par définition (OIV – UE), la somme H2 SO3 + H SO3 - + SO3 – est le « dioxyde de soufre libre« (= SO2 libre), correspondant à l'ensemble des formes minérales du SO2 . Elles étaient autrefois dites « directement oxydables par l'iode en milieu acide », selon le principe du dosage par la méthode RIPPER.
4.3 Le SO2 en solutions organiques
En solution organique complexe, comme les moûts et vins, le SO2 réagit avec de nombreux composés avec lesquels il forme le « SO2 combiné » selon diverses réactions d'équilibre ayant l'équation générale suivante :
SO2 libre + composé organique  SO2 combiné
SO2 combiné
Ces combinaisons sont détaillées plus loin (§ 4.4.3)
4.4.La chimie du SO2 en œnologie
4.4.1. Dosages du SO2
Connu depuis plus d'un siècle, le dosage connaît aujourd'hui un nombre considérable de variantes, officielles et/ou usuelles., avec des principes et des résultats très différenciés .La méthode usuelle (dite « RIPPER ») est basée sur l'oxydation directe du SO2 en milieu acide directement sur le vin (SO2 libre) , ou après « décombinaison » en milieu alcalin (SO2 total).. La méthode de référence (dite « Franz PAUL ») est basée sur le déplacement du SO2 par un courant gazeux à froid (SO2 libre) ou à chaud (SO2 total) suivi d'une oxydation en sulfates et dosage acidimétrique. Ces méthodes ont une bonne répétabilité et donnent des résultats proches pour les teneurs usuelles des vins blancs secs mais avec des variabilités et des écarts parfois importants pour le SO2 libre des vins rouges, le SO2 total des moûts et vins riches en sucres… Sans développer ici ces méthodes, leurs avantages , inconvénients et améliorations possibles , on peut indiquer quelques « Bonnes pratiques des dosages de SO2 » :
- Privilégier les méthodes officielles ou raccordées aux méthodes officielles selon les procédures retenues pour les laboratoires d'analyses accrédités par le COFRAC.
- Utiliser systématiquement les mêmes méthodes, par le même laboratoire, pour suivre les évolutions du SO2 en se rappelant que l'incertitude acceptée entre laboratoires (= reproductibilité) par les méthodes officielles est élevée : 9 mg/L au dessous de 50 mg/L et 15 mg/l au delà de 50 mg/L (Recueil OIV-2003)
- Gérer les teneurs en SO2 à partir de l'expérience accumulée dans ces conditions.
4.4.2. Le SO2 actif
La plupart des effets du SO2 sont habituellement liés à la seule teneur en SO2 libre mais on a observé que l'essentiel de cette activité, surtout vis à vis des microorganismes, était liée au taux de « SO2 moléculaire », appelé « SO2 actif ». (MOREAU et VINET-1937 ; PATO-1938 ; RAHN et COHN – 1944)
Le SO2 moléculaire est la seule forme H2 SO3 , non ionisée. A partir de l'équation (4), en appelant L la forme non dissociée H2 SO3 - et S la forme ionisée (= salifiée) et en négligeant la forme SO3 - - , très peu abondante aux PH des moûts et vins, on peut écrire :

Connaissant la constante K1, le SO2 libre et le pH de chaque vin, on peut calculer le pourcentage de SO2 libre sous forme de SO2 actif.
Rappel : pK = - log K ; k = 10^-pk
• Calcul du SO2 actif
Les valeurs de pK1 (= -log K1 sont fournies par diverses tables pour les solutions aqueuses à 20°C. Cette valeur doit être corrigée de l'influence de la température T (°C ) , de l'alcool TAV (% vol) et de le force ionique I (= somme des activités des ions du milieu , en mole/litre). Ces facteurs modifient l'activité ionique, théoriquement égale à 1 , en réduisant la mobilité , et donc l'activité , des ions qui n'est totale qu'en solution «idéale » (y = 1). On doit écrire :

Le calcul précis de y devrait prendre en compte tous les ions à partir d'une analyse exhaustive des anions et cations et calculs itératifs avec ces concentrations, leurs activités , la température, l'alcool et le pH et. On peut effectuer un calcul fiable à l'aide du logiciel MEXTAR® - établi pour les calculs de stabilisation tartrique et de maîtrise de l'acidité. Plus simplement on établit des formules d'une précision technique suffisante à partir des travaux de USSEGLIO-TOMASSET utilisés par les tables des méthodes officielles de l'OIV (Méthode MA-F-AS323-04-DIOSOU) ou les valeurs ci-dessous déduite de ces tables .
On calcule ainsi :
On a ainsi la formule facile à manipuler par calculette , pour une valeur moyenne de I = 0 ,0.38 mole/L :
pK1 = 1,9499 + (T-20) x 0,0322 + (TAV – 10) x 0,01971 |
Les valeurs de pK ainsi utilisée sont différentes, nettement supérieures et plus exactes que les valeurs usuelles de pK = 1,7 – 1,8 adaptées aux seules solutions aqueuses simples. La figure 4.4.2-1 montre les variations du taux de SO2 actif en fonction du pH, de la température en valeur absolue et par rapport à des valeurs moyennes usuelles.
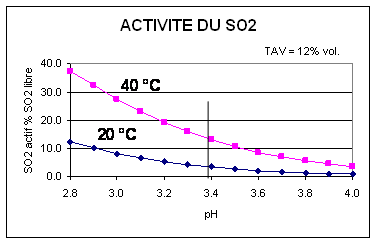
Fig 4-4-2-1 : Activité du SO2 selon pH et température
|
- L'activité augmente beaucoup lorsque le pH s'abaisse, d'environ +25% pour – 0.1 pH
• L'activité augmente avec le taux d'alcool , d'environ 1 à 2 en passant du moût au vin mais les différences entre vins sont faibles, de l'ordre de 0,1% de SO2 actif par % vol.0 entre 10 et 14%.
• L'activité croît rapidement avec la température puisqu'elle est 4 fois plus élevée à 40°C qu'à 20°C. Cet accroissement continue au delà , à des niveaux mal connus, et contribue à renforcer l'effet germicide de la chaleur appliquée aux vins.
• L'activité croît avec le pKm : elle est environ deux fois plus grande avec pK = 2, comme calculé ci-dessus selon les règles de l'OIV, que pour pK= 1,7 souvent utilisé.
• Les variations de la valeur de la force ionique, autour de 0,038 mole/L retenue dans ces calculs, est limité.
- Teneurs en SO2 actif
Malgré leur importance pratique, les valeurs optimales du SO2 actif sont mal connues, très variables selon les sources. Pratiquement, il convient à chaque utilisateur de déterminer les doses optimales pour les conditions selon les conditions rencontrées : type de vin, température hygiène générale, risques spécifiques … On peut utilement s'inspirer des chiffres indicatifs ci-dessous, même s'ils se révèlent souvent trop élevés, surtout pour les vins rouges (voir § 2.1).
| Micro-organismes |
SO2 actif inhibiteur (mg/L) |
| Levures « oxydatives » |
0,3
|
| Levures de fermentation |
0,4 à 3
|
| Levures de contamination |
2,5
|
| Bactéries lactiques |
2,3 à 3,7
|
Sensibilité des micro-organismes au SO2 actif (d'après BEECH-1979 et USSEGLIO-TOMASSET-1982)

![]()
