4.4.3. Combinaisons du SO2
La distinction entre SO2 total (= SO2 ajouté) et le SO2 libre (= réagissant directement avec l'iode lors du dosage par la méthode RIPPER) est connue depuis plus d'un siècle (SCHMIDT-1893). La différence (SO2 combiné) a d'abord été attribuée à une combinaison avec les sucres, l'aldéhyde éthylique puis diverses autres substances. On connaît depuis peu l'ensemble du phénomène.
• Mécanisme général de la combinaison du SO2 dans les vins
L'essentiel des combinaisons du SO2 en œnologie intervient avec les composés carbonylés (corps ayant une ou plusieurs fonctions aldéhyde ou cétone).
On a l'équation générale ci-dessous :
Il a été montré que la forme de SO2 la plus réactive est HSO3 - (CHABANEIX, BLOUIN-1997)
Cet équilibre est régit par la loi d'action de masse définie par la constante de dissociation Kd. On a alors (1):
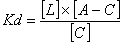 (1)
(1)
avec L = concentration en SO2 libre (mM/L) , = SO2 libre (mg/L) /64
C = concentration en SO2 combiné (mM/L) , = SO2 combiné (mg/L) /64
A = concentration en carbonyle total (mM/L) ,(= carbonyle total (mg/L) / masse molaire)
Kd = Constante de dissociation (mM)
Remarque importante : Kd étant une constante de dissociation, les valeurs faibles correspondent à des combinaisons fortes, et inversement
• Pour les valeurs faibles de Kd , inférieures à 0,01 mM , la combinaison est pratiquement totale pour des teneurs très faibles en SO2 libre, inférieures à 5-10 mg/L
• Pour des valeurs élevées, supérieures à 1 à 10 mM, la combinaison varie fortement avec la teneur en SO2 libre et la combinaison n'est jamais totale. Elle croît si le SO2 libre augmente, mais elle décroît s'il diminue, en libérant du SO2 libre.
• En schématisant, on peut dire que les substances à Kd faible aboutissent à du SO2 combiné « bloqué » alors que les substances à Kd plus élevé produisent du SO2 combiné « libérable ». Ces notions théoriques ont une importance pratique considérable.
CALCUL DE LA CONSTANTE DE DISSOCIATION Kd
La représentation graphique de C = f (L) (Figure 4.4.3-1) montre que le taux de SO2 combiné tend asymptotiquement vers une valeur égale à A, pour une valeur (très) élevée de L. Par ailleurs, pour L = Kd , on a :
C = L x A / (L + L) ; C = A / 2
Connaissant A/2, on peut calculer Kd.

Figure 4.4.3-1 : Courbe de combinaison du SO2
Cette méthode est peu pratique, peu précise .On peut également écrire l'équation (1) sous les formes équivalentes suivantes ,transformant la courbe asymptotique en droites, représentées par la figure 4.4.3-2 :
C = L x A / (Kd + L) (2)
L = Kd x C / (A – C) (3)
A = C x (Kd +L) / L (4)
A partir de (2) , on peut écrire :
1/C = (Kd +L) / (L x A) (5)
1 /C = Kd / A x 1/L + 1/A (6)
Donc: 1/C = f (1/L) , ou y = a X + b , avec y = 1/c et X = 1/L , caractérisable par les points suivants:
Cette transformation permet le calcul direct de Kd, et de A (concentration en composé carbonylé), y compris pour les substances de pureté et/ou de concentration inconnue.
Connaissant l'incertitude sur les coefficients a et b, on peut calculer l'incertitude sur Kd et A.
On a :
dKd / Kd = da / a + db / b
dA / A = db / b
(db et da = incertitude sur b et a, exprimé par les écart-types directement fournie par Excel )
Par d'autres transformations analogues à partir des équations (2) et (3), on peut linéariser et connaître les incertitudes des valeurs de Kd et A (pour tenir compte des éventuelles impuretés) selon la transformation,

Figure 4.4.3-2 : Droite de combinaison du SO2
|
Cette méthode est théoriquement applicable avec deux couples de valeurs SO2 L / SO2 C mais il est souhaitable de disposer d'au moins trois couples de données pour estimer la linéarité (Ex : valeur du coefficient de corrélation r). L'utilisation simultanée des trois méthodes de calcul permet de vérifier la cohérence des résultats. La fonction L/C = f (L) est habituellement la plus satisfaisante. L'incertitude finale sur le SO2 combiné (C-L50) est habituellement faible, limitée à quelques mg/L.
Exemple :
a = 1,2 +/- 0,007 et b = 0,8 +/- 0,07
Kd = 0,66 +/- 0,06 mM et A = 0,83 +/- 0,01 mM .
RESULTATS PRATIQUES
Selon les valeurs de Kd, on obtient les courbes de combinaison suivantes de divers composés carbonylés pouvant se trouver dans les vins en présence d'un excès de SO2 , à la dose indicative de 100 mg/L (Figure 4.4.3-3).
Il est souvent utile d'exprimer globalement la combinaison par le SO2 combiné pour une teneur fixe en SO2 libre . Exemple : C-L50 = SO2 combiné pour 50 mg/L de SO2 libre. Cette notion de C-L50, d'abord établie pour les vins doux (BLOUIN -1964) semble la meilleure méthode d'exprimer simplement la combinaison "pratique" du S0 2, pour calculer les sulfitages. On peut utiliser le C-L20 ou le C-L30 pour les vins secs, blancs ou rouges.
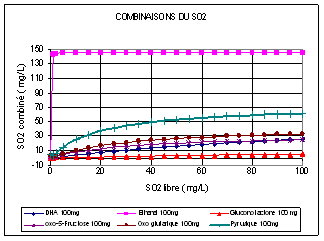
Figure 4.4.3-3 : Courbes de combinaison du SO2 de divers constituants des vins
|
Il apparaît que l'éthanal est pratiquement combiné à 100 % par le SO2, même en présence de dose très faible de SO2 libre : on peut parler de « SO2 combiné bloqué ». Dans ces conditions il ne peut exister à la fois des quantités perceptibles de d'éthanal et un taux de SO2 libre (supérieur à environ 3-5 mg/L). De la même façon un teneur normale de 22 – 44- 66 mg/L d'éthanal (soit 0,5-1 –1,5 millimoles) entraîne une teneur de SO2 combine de 32-64-96 mg/L de SO2 combiné. Tous autres résultats doivent attirer l'attention sur la fiabilité des résultats analytiques. Au contraire la combinaison est faible pour la plupart des autres composés, avec des variations importantes pour les teneurs faibles en SO2 libre, puis des variations du taux de combinaison presque proportionnelles pour des teneurs plus élevées. : on peut parler de « SO2 combiné libérable ».
LES COMPOSES COMBINANT LE SO2 DANS LES MOUTS ET VINS
Les études menées depuis 50 ans (2) et achevées récemment (3) ont mis en évidence plusieurs dizaines de composés carbonylés combinants le SO2 dans les moûts et/ou les vins. Le tableau ci-dessous (Figure 4.4.3- 4 ) rassemble les composés les plus importants.

Fig 4-4-3-4 : Principaux composés carbonylés combinant le SO 2
|
• Dans les moûts issus de raisins sains (ou peu pourris), la quasi-totalité du SO2 est combiné à l'acide pyruvique, à l'acide oxoglutarique et plus faiblement au glucose. Le rôle des autres composés est négligeable (quelques %).
• Dans les vins blancs issus de raisins sains (ou peu pourris), la combinaison est expliquée par la présence d'éthanal, d'acide pyruvique et d'acide oxoglutarique .
• Dans le cas de raisins fortement atteint pour les pourritures – pourriture grise mais surtout pourritures « blanches, vertes, bleues… » et pourriture « aigre »- on observe la présence de très nombreux autres composés très « combinants » et/ou très abondants. Dans ces conditions on arrive à un bilan complet du SO2 combiné qui est ainsi complètement expliqué. Dans ces situations la combinaison du SO2 découlent du développement sur le raisin de diverses moisissures autres que le Botrytis cinerea et surtout de bactéries acétiques (BLOUIN-1963).
• Les solutions hydro-alcoolique d'acide tartrique, en présence de traces de fer et de cuivre, forment d'importantes quantités de produits combinants le SO2 (BARRAUD-1954, BERTRAND-MOTARD, NIVELLE, BLOUIN – 1995). Leur rôle est mal connu dans les vins.
• Les différentes formes du SO2 sont moins bien connues dans le cas des vins rouges où les anthocyanes et autres composés phénoliques combinent le SO2 selon des équilibres mal quantifiés. La figure 4.4.3-5 donne la courbe de combinaison d'une solution d'anthocyanes libres, alors que la majorité des anthocyanes des vins est sous forme de complexes divers, pour les valeurs usuelles de Kd .(0,4–0,6 ). Le SO2 combiné à 500 mg/L d'anthocyanes serait ainsi de l'ordre de 50-60 mg/L.
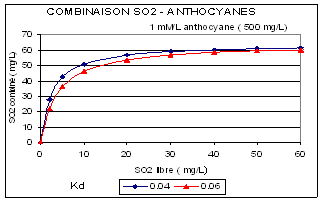
Figure 4.4.3-5 : Combinaison du SO2 par les anthocyanes
|
PRATIQUEMENT :
• L'éthanal est produit par toute fermentation alcoolique, à la dose de 20-50 mg/L en conditions normales . Le taux est plus élevée en cas de fermentations languissantes, en cas de carence en thiamine. On réduit cette difficulté par addition de thiamine (0,5-0,6 mg/L, après sulfitage , en début de fermentation). Il y aussi formation d'éthanal en fin de fermentation , lors du mutage des vins moëlleux, avec des teneurs pouvant être très élevées en cas d'arrêt de fermentation trop lent, jusqu'à 100-200 mg/L. La formation d'éthanal par oxydation de l'éthanol est normalement nulle ou négligeable, sauf pour les vins de type oxydatif où elle est recherchée.
• L'acide pyruvique est présent dans tous les moûts et il se forme lors de la fermentation alcoolique avec une teneur normale d'environ 10-40 mg/L, plus élevée lors de la fermentation de moûts issus de raisins pourris. L'addition de thiamine réduit cette accumulation parasite.
• L'acide oxoglutarique (= cétoglutarique) est surtout formé par le raisin et lors des fermentations déviantes observées sur les moûts issus de raisins pourris. La thiamine a une action favorable limitée.
• Le SO2 combiné dans les moûts issus de raisins sains est de l'ordre de 5-30 mg/L.
• Les composés combinant le SO2 issus des fortes pourritures sont abondants dans le raisin – 5.oxo fructose, gluconolactone, dihydroxyacétone, glyoxal, méthyl glyoxal …- et évoluent au cours de la fermentation de façon variable selon les conditions (vitesse, souche de levures, sulfitage…) mais le pouvoir de combinaison reste généralement très élevé, jusqu'à 50-100-200 mg/L – exprimé par le C-L50 - et parfois beaucoup plus.
• Le dosage des principaux composés combinants est facilement réalisable par voie enzymatique (éthanal, acide pyruvique, acide oxoglutarique, glucose mais aussi acide oxalacétique, acide gluconique, dihydroxyacétone, glycéraldéhyde…) ou par chromatographie. Ils permettent d'établir ainsi le bilan du SO2 combiné et de déterminer le « SO2 résiduel » (selon KIELHOFER-1956) non combiné au composants principaux (éthanal, acide pyruvique, acide oxoglutarique) mais à des composés issus de raisins altérés.
CALCUL DU « CARBONYLE EQUIVALENT »
Le mélange de composés combinant le SO2 peut être assimilé à un seul composé « carbonyle équivalent » (BERTRAND-MOTARD, BLOUIN – 1995), caractérisé par une concentration globale A et une constante de dissociation Kd (comme l'ensemble des acides par l'acidité totale et le pH qui pourrait conduire à un pK global).
On peut utiliser la procédure ci-dessous :
- Analyse du SO2 libre et du SO2 total du vin , du SO2 combiné .
- Visualisation du point C = f (L ) , en mg/L (Figure 4.4.3- 6 )
- Ajout des 2 concentrations de SO2 (mg/L) préconisées selon la zone définie expérimentalement : 100-120 et 220-240 entre les courbes supérieures, 90-110 et 150-170 pour la zone entre les courbes inférieures.
- Après 4 à 6 jours en bouteille pleine , analyses du SO2 libre et du SO2 total des 2 lots .
- Calcul des paramètres A , Kd ,C-L50
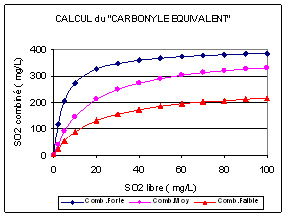
Figure 4.4.3-6 : Courbes d'aide ai calcul du « Carbonyle équivalent »
|
Connaissant ces caractéristiques pour un vin, il est facile de calculer les quantités de SO2 total à ajouter pour obtenir la dose de SO2 libre souhaitée à l'aide des formules (2), (3), (4). Ces déterminations simples permettent des sulfitages très précis, de qualité, à coût très limité par rapport à la valeur du vin traité. La figure 4.4.3-7 donne quelques exemples de résultats observés sur des vins issus de raisins très pourris. On note la bonne relation entre le taux de SO2 combiné et le taux de « carbonyle équivalent » qui peut être pris en compte comme une caractéristique essentielle de chaque vin.
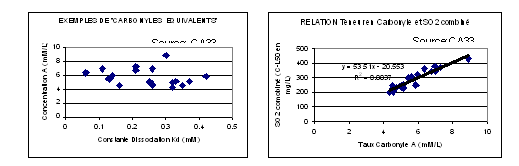
Figure 4.4.3-7 : Exemples d'application du « Carbonyle Equivalent »
|
|
(2) J. BLOUIN - 1966
(3) I. GUILLOU - LARGETEAU - 1966, C. DUHAIL - 1999, JV. BARBE - 2000

![]()
